Treten Sie dem Forum für Designer bei!
Ihr Fachwissen ist wichtig für die Gemeinschaft. Helfen Sie uns und bringen Sie Ihr Wissen ein!
Jetzt dem Forum beitretenTauschen Sie sich aus, lernen Sie und wachsen Sie mit den besten Fachleuten der Branche.
Metalloide sind einzigartige natürliche Elemente, die sowohl Eigenschaften von Metallen als auch von Nichtmetallen besitzen. Ihre besonderen Eigenschaften machen Metalloide in verschiedenen Szenarien unersetzlich. Dieser Artikel beschäftigt sich mit dieser Gruppe von Elementen und erörtert ihre Eigenschaften, Anwendungen und Positionen im Periodensystem. Wir geben auch einen kurzen Überblick über jedes allgemein bekannte Metalloid.
- Metalloide weisen auf Eigenschaften, die eine Mischung aus Metallen und Nichtmetallen sindDadurch sind sie vielseitig für eine breite Palette von allgemeinen und speziellen Anwendungen einsetzbar.
- Sie besetzen einen Zickzacklinie im Periodensystem. Metalle liegen auf einer Seite dieser Diagonale und Nichtmetalle auf der anderen. Diese Anordnung zeigt auch ihre hybriden Eigenschaften an.
- Metalloide besitzen bedeutende Bedeutung in der Technologie, insbesondere in der Herstellung von Halbleitern. Halbleiter sind wesentliche Bestandteile von Computern, Elektronik und Solarzellen.
- Einige Metalloide, wie Tellur und Antimon, haben eine bedeutende wirtschaftliche und strategische Bedeutung aufgrund ihrer Knappheitwas die Verteidigung, die Energieerzeugung und die Automobilindustrie stark beeinträchtigen kann.
Was sind Metalloide?
Metalloide sind charakteristische Elemente, die Eigenschaften besitzen, die zwischen Metallen und Nichtmetallen liegen. Zu diesen Zwischeneigenschaften gehören Elektronegativität, Dichte, Ionisierungsenergie, Festigkeit, Wärmeleitfähigkeit, Schmelzpunkt und elektrische Leitfähigkeit.
Die spezifischen physikalischen, chemischen und mechanischen Eigenschaften von Metalloiden machen sie zu idealen Materialien für spezielle Anwendungen wie Halbleiter und Solarenergie. Darüber hinaus werden sie in verschiedenen allgemeinen Anwendungen eingesetzt, darunter Medikamente, Herbizide und Insektizide.
Einer der Gründe für die Zwischeneigenschaften von Metalloiden ist die Anzahl der Valenzelektronen in ihrer äußeren Schale. Metalle besitzen in der Regel ein bis drei Elektronen in ihrer äußeren Schale, während Nichtmetalle vier bis sieben haben. Metalloide haben drei bis sechs Elektronen in ihrer Valenzschale, wodurch sie intermetallische Verbindungen mit Metallen (ionische Bindungen) und kovalente Bindungen mit Nichtmetallen eingehen können.
In einigen Quellen werden sechs metalloide Elemente genannt, während andere bis zu acht erkennen. Zu den allgemein anerkannten Elementen der Gruppe der Metalloide gehören Bor (B), Arsen (As), Silizium (Si), Antimon (Sb), Polonium (Po), Tellur (Te), Germanium (Ge), und Astatin (At).
Metalloide im Periodensystem
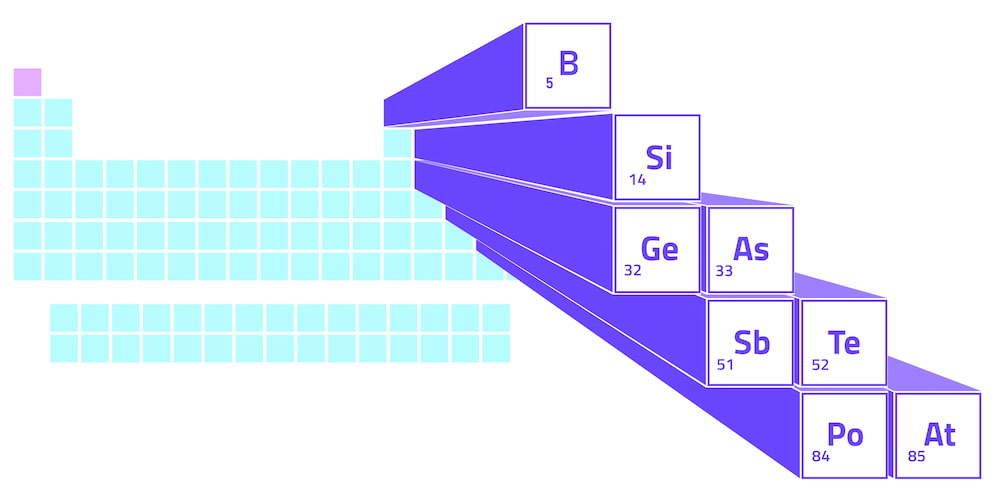
Metalloide bilden eine Zickzacklinie im p-Block des Periodensystems, d.h. dem erhöhten Abschnitt auf der rechten Seite der Tabelle. Diese Zickzacklinie beginnt bei Bor in Gruppe 13, verläuft diagonal zu Silizium und setzt sich dann stufenförmig zu Astatin in Gruppe 17 fort. Die Gruppen beziehen sich auf die Nummerierung der Spalten im Periodensystem.
Auf der linken Seite der Zickzacklinie der Metalloide finden wir die Metalle (mit Ausnahme von Wasserstoff). Auf der rechten Seite finden wir die Nichtmetalle. Daher ist die Metalloide eine Trennungslinie zwischen Metallen und Nichtmetallen im Periodensystem.
Allgemeine Eigenschaften von Metalloiden
Metalloide weisen eine einzigartige Kombination von Eigenschaften auf, die in anderen Elementen nicht vorhanden sind. Einige dieser Eigenschaften sind:
Variable elektrische Leitfähigkeit
Die elektrische Leitfähigkeit von Metalloiden liegt zwischen derjenigen von Metallen und Nichtmetallen. Dies ist auf ihre elektronischen Bandstrukturen zurückzuführen, die denen von Halbmetallen oder Halbleitern ähneln.
Wir können jedoch ihre Leitfähigkeit durch Dotierung verbessern. Dieser Prozess ermöglicht die Herstellung wichtiger elektronischer Komponenten wie Dioden, Transistoren und integrierter Schaltungen, die für die moderne Computertechnik von grundlegender Bedeutung sind.
Erscheinungsbild
Metalloide haben ein metallisches Aussehen und sind bei Raumtemperatur fest. Ihre glänzenden, reflektierenden Oberflächen führen oft dazu, dass sie fälschlicherweise als Metalle identifiziert werden. Dieser metallische Glanz ist auch der Grund für den Ursprung ihres Namens; metalloid bedeutet auf Lateinisch/Griechisch metallähnlich.
Thermische Leitfähigkeit
Metalloide weisen eine moderate Wärmeleitfähigkeit auf, die höher ist als die von Nichtmetallen, aber niedriger als die von Metallen. Selbst unter den acht Metalloiden variiert die Wärmeleitfähigkeit erheblich. Einige Metalloide sind effektive Wärmeleiter, während andere als nahezu perfekte Isolatoren fungieren. Diese Eigenschaft ermöglicht die Verwendung bestimmter Metalloide in thermoelektrischen Geräten.
Sprödigkeit
Im Gegensatz zu Metallen verfügen Metalloide nicht über die physikalischen Eigenschaften der Duktilität und Formbarkeit. Sie brechen leicht und haben nicht die für strukturelle Anwendungen erforderliche Festigkeit.
Chemische Reaktivität
Metalloide sind ziemlich reaktiv mit Metallen und Nichtmetallen. Sie sind häufig in Metalllegierungen als Zusatzstoffe zu die Eigenschaften von Übergangsmetallen zu verbessern, was Vorteile wie erhöhte Festigkeit und verbesserte Korrosionsbeständigkeit mit sich bringt.
Metalloide bilden mit Nichtmetallen kovalente Bindungen, indem sie Elektronen austauschen. Ihre Reaktionen mit Halogenen bilden Verbindungen wie Bortrifluorid, Antimontrioxid und Siliziumtetrahalogenid.
Häufige Metalloide und ihre Anwendungen
Alle Metalloide weisen bestimmte gemeinsame Eigenschaften auf. Im Gegensatz zu anderen Elementgruppen wie Halogenen, Alkalimetallen oder Erdalkalimetallen besitzt jedes Metalloid jedoch auch einzigartige Merkmale. Diese Vielfalt ermöglicht die Verwendung von Metalloiden in einer Vielzahl von Anwendungen.
Bor (B)
Bor ist ein schwarzes, glänzendes Metalloid, das etwa 0,001% des Gewichts der Erdkruste ausmacht. Es ist das härteste aller Metalloide und weist auf ausgezeichnete Hitzebeständigkeit. Sein Mohs-Härtegrad beträgt 9,3, verglichen mit 10 für Diamant, dem härtesten bekannten Material.
Bor ist ein vielseitiges Element mit einer Reihe von Anwendungen. Eine davon ist die Herstellung von Borosilikatglas, einem Spezialglas mit hoher Hitze- und Chemikalienbeständigkeit. Es wird auch zur Herstellung von Flammschutzmitteln, Kosmetika, Insektiziden und Reinigungsmitteln verwendet.
Nickel-Bor-Legierungen werden als Vorlegierungen zur Herstellung von Legierungen wie Superlegierungen auf Nickelbasis, Spezialstählen und Schweißlegierungen verwendet.
Bor spielt auch bei der Dotierung von Silizium eine wichtige Rolle. Die Dotierung ermöglicht die Herstellung von Halbleitern auf Siliziumbasis, die für die moderne Computertechnik unverzichtbar sind.
Silizium (Si)
Silizium ist das bekannteste Metalloid und das zweithäufigste Element auf der Erdenach Sauerstoff. Es macht etwa 27% des Gewichts der Erdkruste aus.
Bei Umgebungstemperaturen ist es im Allgemeinen inert, seine Reaktivität nimmt jedoch mit der Temperatur zu. Es verbindet sich mit Sauerstoff zu Kieselsäure (Siliziumdioxid), die in den meisten Tonen, Felsen, Sanden und Böden enthalten ist. Es verbindet sich mit den meisten Metallen und Metalllegierungen und verleiht ihnen Eigenschaften wie Fließfähigkeit, Korrosionsbeständigkeit, Festigkeit und Hitzebeständigkeit.
Siliziumdioxid und reines Silizium sind wichtige Materialien in der modernen Computertechnik. Siliziumdioxid wird verwendet zur Herstellung von Kondensatoren, die elektrische Energie speichern in Schaltkreisen speichern. Silizium, das zur Herstellung von Kondensatoren verwendet wird kritischen elektronischen Chip-Komponentenermöglicht es uns, kleinere, schnellere und leistungsfähigere elektronische Geräte zu entwickeln.
Germanium (Ge)
Direkt unter Silizium im Periodensystem befindet sich das Metalloid Germanium mit einer Ordnungszahl von 32.
Germanium kommt häufiger vor als andere Metalloide, wie Arsen und Antimon. Allerdings ist sein hohe Reaktivität mit anderen Elementen bedeutet, dass es in der Natur nicht in seiner elementaren Form vorkommt. Bei Raumtemperatur hat Germanium eine harte und spröde Struktur und reagiert nicht mit Luft. Mit steigender Temperatur nimmt jedoch auch seine Reaktivität zu, was zur Bildung von Oxiden bei etwa 600-700 Grad Celsius (1000-1100 Grad Fahrenheit) führt.
Germanium wird auch in der Halbleiterindustrie verwendet, wenn auch in geringerem Maße als Silizium. Außerdem wird es in der Medizin und bei der Herstellung von Münzen verwendet.
Arsen (As)
Das chemische Element Arsen, das zur Gruppe 15 gehört und eine Ordnungszahl von 33 hat, ist ein Metalloid, das für seine giftige Natur. Bei Raumtemperatur ist Arsen stabil und reagiert nicht mit Luft. In Gegenwart von Feuchtigkeit oxidiert es jedoch und bildet einen gold-bronzefarbenen Schimmer, der sich schließlich schwarz verfärbt.
Die langfristige Aufnahme von Arsen über die Nahrung und das Wasser kann zu schweren Krankheiten, einschließlich Krebs, führen. Es ist jedoch erwähnenswert, dass Arsen für einige Organismen ein essentielles Spurenelement ist. Es spielt eine direkte und indirekte Rolle bei der Produktion von sowohl nützlichen als auch schädlichen biologischen Wirkstoffen.
Arsen wird auch in anderen Bereichen wie der Glasherstellung, der Halbleiterproduktion, der Agrarchemie und dem Bergbau verwendet.
Antimon (Sb)
Antimon, mit der Ordnungszahl 51, befindet sich in Gruppe 15 des Periodensystems, direkt unter Arsen. Es besitzt eine harte und spröde Strukturund zeichnet sich durch ein silbriges Aussehen aus.
Der größte Teil des Antimons wird aus dem Sulfidmineral Stibnit gewonnen, wobei China, Russland, Bolivien und Kirgisistan über die meisten Antimonreserven verfügen. Außerdem ist China der größte Antimonproduzent der Welt.
Antimon wird traditionell für medizinische und kosmetische Zwecke verwendet. Im Laufe der Zeit wurde es auch für die Herstellung von flammhemmenden Materialien, Farben, Batterien, Glas, Töpferwaren, optischen Speichermedien und Halbleitergeräten wie Dioden und Infrarotdetektoren wertvoll.
Für Europa und die Vereinigten Staaten ist Antimon ein kritisches Element, da es zu 100% importiert wird. Eine Unterbrechung der Versorgung könnte wichtige Industrien wie die Automobil-, Bau- und Verteidigungsindustrie stark beeinträchtigen.
Tellur (Te)
Tellur ist ein seltenes, silbrig-weißes Metalloid, das zuerst in Goldminen als Goldtellurid (auch bekannt als Calaverit) entdeckt wurde. Mit einer Häufigkeit von 1 Teil pro Milliarde (1 Mikrogramm pro Kilogramm) ist Tellur so selten wie Platin.
Bisher wurden noch keine groß angelegten Anwendungen für Tellur gefunden. In der Industrie wird Tellur hauptsächlich als Legierungselement und bei der Herstellung von Solarzellen und thermoelektrischen Geräten verwendet.
Polonium (Po)
Polonium ist ein radioaktives Metall das manchmal als Metalloid eingestuft wird. Es hat 42 Isotope, von denen keines stabil ist und die alle radioaktiv sind. Die Halbwertszeit der Polonium-Isotope reicht von 115 Nanosekunden (Milliardstelsekunden) für Po-205m4 bis zu 124 Jahren für Po-209.
Für Polonium gibt es mehrere Anwendungen, die alle seine radioaktiven Eigenschaften nutzen. Einige davon sind:
- Als thermoelektrischer Generator für die Raumfahrt
- Als antistatisches Gerät zur Beseitigung statischer Aufladung
- Als Neutronenquelle in Kombination mit Beryllium
Astat (At)
Astat wird jedoch im Allgemeinen als Metalloid eingestuft, einige Klassifizierungen stufen es als Nicht-Metall ein. Es ist das vorletzte Element in der Gruppe der Halogene, vor Fluor, Chlor, Brom und Jod, und es weist einige gemeinsame Eigenschaften mit diesen Elementen auf.
Astat ist hochradioaktivund seine Eigenschaften müssen noch eingehend untersucht werden, da es noch nie in ausreichenden Mengen für eine gründliche Analyse synthetisiert wurde. Außerdem sublimiert es so schnell, dass Sie innerhalb einer Stunde die Hälfte davon verlieren können.
Astatin hat begrenzte Anwendungsmöglichkeiten aufgrund seiner Radioaktivität und kurzen Halbwertszeit. Dennoch wurde es in der Forschung eingesetzt, vor allem als radioaktiver Tracer und zur Behandlung von Schilddrüsenkrebs.
Schlussfolgerung
Metalloide sind eine wichtige Gruppe von Elementen, die die Kluft zwischen Metallen und Nichtmetallen überbrücken. Ihre Kombination aus metallischen und nichtmetallischen Eigenschaften ermöglicht ihren Einsatz in sehr unterschiedlichen Branchen, von der Landwirtschaft bis hin zu optischen Speichern und der Optoelektronik.
Vor allem ihre halbleitenden Eigenschaften haben die Technologie und die moderne Computertechnik entscheidend vorangebracht. Einige Metalloide, wie z.B. Arsen, sind giftig, aber ihr kontrollierter Einsatz bietet in verschiedenen Bereichen unvergleichliche Vorteile.
Aus den oben genannten Gründen wird erwartet, dass die Nachfrage nach Metalloiden steigen wird. Allerdings, die Knappheit bestimmter Metalloide hat sie zu kritischen Elementen gemacht. So geht beispielsweise die Produktion von Antimon zurück, da die vorhandenen Quellen schnell erschöpft sind und keine neuen Ersatzstoffe entdeckt werden.
Aus diesem Grund wird es immer wichtiger, nachhaltige Quellen für Metalloide zu finden. Es werden Anstrengungen unternommen, um Metalloide zu erforschen, zu erhalten und zu recyceln.
Treten Sie dem Forum für Designer bei!
Ihr Fachwissen ist wichtig für die Gemeinschaft. Helfen Sie uns und bringen Sie Ihr Wissen ein!
Jetzt dem Forum beitretenTauschen Sie sich aus, lernen Sie und wachsen Sie mit den besten Fachleuten der Branche.

