Únase al foro de diseñadores!
Su experiencia es vital para la comunidad. Únase a nosotros y aporte sus conocimientos.
Únase ahora al ForoComparta, aprenda y crezca con los mejores profesionales del sector.
Los metaloides son elementos naturales únicos que poseen características tanto de los metales como de los no metales. Sus propiedades distintivas hacen que los metaloides sean insustituibles en diversos escenarios. Este artículo explora este grupo de elementos, discutiendo sus propiedades, aplicaciones y posiciones en la tabla periódica. También ofreceremos una breve descripción de cada metaloide comúnmente reconocido.
- Los metaloides exhiben propiedades que son una mezcla de metales y no metales, lo que los hace versátiles para una amplia gama de aplicaciones generales y especializadas.
- Ocupan un línea en zigzag en la tabla periódica. Los metales se sitúan a un lado de esta región diagonal y los no metales al otro. Esta disposición también indica sus propiedades híbridas.
- Los metaloides tienen importantes importancia en la tecnología, en particular en la fabricación de semiconductores. Los semiconductores son componentes esenciales en los ordenadores, la electrónica y los paneles solares.
- Algunos metaloides, como el telurio y el antimonio, tienen importantes importancia económica y estratégica debido a su escasez, lo que puede repercutir gravemente en la defensa, la producción de energía y la industria automovilística.
¿Qué son los metaloides?
Los metaloides son elementos distintivos que poseen propiedades intermedias entre los metales y los no metales. Estas propiedades intermedias incluyen la electronegatividad, la densidad, la energía de ionización, la resistencia, la conductividad térmica, el punto de fusión y la conductividad eléctrica.
El conjunto específico de propiedades físicas, químicas y mecánicas de los metaloides los hace ideales para aplicaciones especializadas, como los semiconductores y la generación de energía solar. Además, se utilizan ampliamente en diversas aplicaciones generales, como medicamentos, herbicidas e insecticidas.
Una de las razones de las propiedades intermedias de los metaloides es el número de electrones de valencia de su capa exterior. Los metales suelen poseer de uno a tres electrones en su capa exterior, mientras que los no metales tienen de cuatro a siete. Los metaloides contienen de tres a seis electrones en su capa de valencia, lo que les permite formar compuestos intermetálicos con metales (enlaces iónicos) y enlaces covalentes con no metales.
Algunas fuentes identifican seis elementos metaloides, mientras que otras reconocen hasta ocho. Los elementos comúnmente reconocidos en el grupo de los metaloides incluyen boro (B), arsénico (As), silicio (Si), antimonio (Sb), polonio (Po), telurio (Te), germanio (Ge) y astato (At).
Los metaloides en la Tabla Periódica
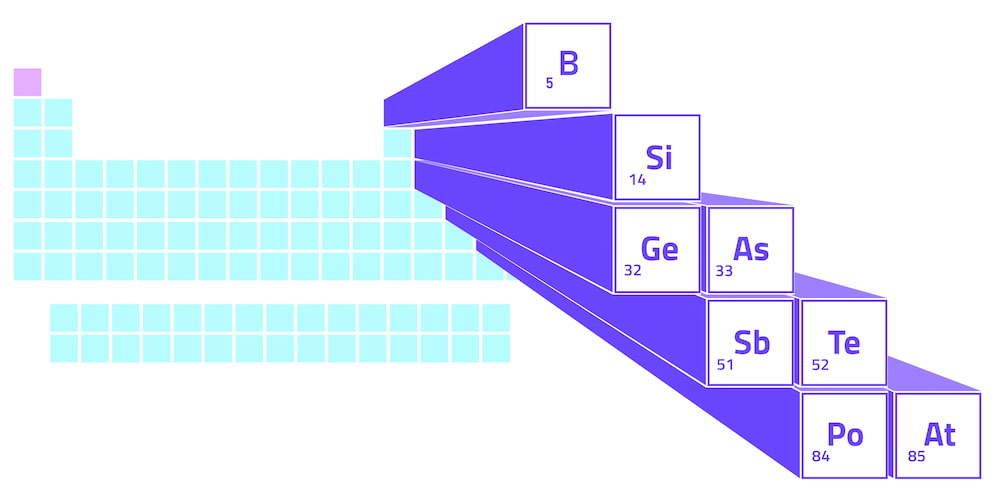
Los metaloides forman una línea en zigzag en el bloque p de la tabla periódica, que es la sección en relieve del lado derecho de la tabla. Esta línea en zigzag comienza en el boro del grupo 13, se desplaza en diagonal hasta el silicio y continúa en forma de escalón hasta la astatina del grupo 17. Los grupos hacen referencia a la numeración de las columnas de la tabla periódica.
En el lado izquierdo de la línea en zigzag de los metaloides, encontramos los metales (a excepción del hidrógeno). En el lado derecho, tenemos los no metales. Por lo tanto, la metaloides crean una línea divisoria entre metales y no metales en la tabla periódica.
Propiedades generales de los metaloides
Los metaloides presentan una combinación única de propiedades que no están presentes en otros elementos. Algunas de estas propiedades incluyen:
Conductividad eléctrica variable
La conductividad eléctrica de los metaloides es intermedia, situándose entre la de los metales y la de los no metales. Esto se atribuye a sus estructuras de banda electrónica, que se asemejan a las de los semimetales o semiconductores.
Sin embargo, podemos mejorar su conductividad mediante el dopaje. Este proceso permite la creación de componentes electrónicos esenciales, como diodos, transistores y circuitos integrados, que son fundamentales para la informática moderna.
Apariencia
Los metaloides tienen un aspecto metálico y son sólidos a temperatura ambiente. Sus superficies brillantes y reflectantes hacen que a menudo se les identifique erróneamente como metales. Este brillo metálico es también la razón del origen de su nombre; metaloide significa parecido al metal en latín/griego.
Conductividad térmica
Los metaloides presentan una conductividad térmica moderada, superior a la de los no metales pero inferior a la de los metales. Incluso entre los ocho metaloides, la conductividad térmica varía significativamente. Algunos metaloides son eficaces conductores del calor, mientras que otros funcionan como aislantes casi perfectos. Esta propiedad permite utilizar ciertos metaloides en dispositivos termoeléctricos.
Fragilidad
A diferencia de los metales, los metaloides no tienen las propiedades físicas de ductilidad y maleabilidad. Se rompen con facilidad y carecen de la resistencia necesaria para aplicaciones estructurales.
Reactividad química
Los metaloides son bastante reactivos con metales y no metales. Son comunes en aleaciones metálicas como aditivos a mejorar las propiedades de los metales de transición, proporcionando beneficios como una mayor resistencia y una mejor resistencia a la corrosión.
Con los no metales, los metaloides forman enlaces covalentes compartiendo electrones. Sus reacciones con los halógenos forman compuestos como el trifluoruro de boro, el trióxido de antimonio y el tetrahaluro de silicio.
Metaloides comunes y sus aplicaciones
Todos los metaloides comparten ciertas propiedades comunes; sin embargo, a diferencia de otros grupos de elementos como los halógenos, los metales alcalinos o los metales alcalinotérreos, cada metaloide posee también características únicas. Esta diversidad permite utilizar los metaloides en una amplia gama de aplicaciones.
Boro (B)
El boro es un metaloide negro y lustroso que constituye aproximadamente el 0,001% de la corteza terrestre en peso. Es el más duro de todos los metaloides y presenta excelente resistencia al calor. Su valor de dureza Mohs es de 9,3, frente al 10 del diamante, que es el material más duro conocido.
El boro es un elemento versátil con diversas aplicaciones. Una de ellas es la producción de vidrio borosilicato, un vidrio especial de gran resistencia térmica y química. También se utiliza para producir retardantes de llama, cosméticos, insecticidas y detergentes.
Las aleaciones de níquel-boro se utilizan como aleaciones maestras para formar aleaciones como las superaleaciones a base de níquel, aceros especiales y aleaciones para soldadura.
El boro también es decisivo en el dopaje del silicio. El dopaje permite producir semiconductores a base de silicio, indispensables para la informática moderna.
Silicio (Si)
El silicio es el metaloide más conocido y el segundo elemento más abundante en la Tierra, después del oxígeno. Constituye aproximadamente el 27% de la corteza terrestre en peso.
Generalmente es inerte a temperatura ambiente, sin embargo, su reactividad aumenta con la temperatura. Se combina con el oxígeno para formar sílice (dióxido de silicio), que se encuentra en la mayoría de las arcillas, rocas, arenas y suelos. Se combina con la mayoría de los metales y aleaciones metálicas, lo que le confiere propiedades como fluidez, resistencia a la corrosión, solidez y resistencia al calor.
La sílice y el silicio puro son materiales esenciales en la informática moderna. La sílice se utiliza para producir condensadores que almacenan energía eléctrica en los circuitos. El silicio, que se utiliza para fabricar componentes críticos de chips electrónicos, nos permite crear dispositivos electrónicos más pequeños, rápidos y potentes.
Germanio (Ge)
Justo debajo del silicio en la tabla periódica, tenemos el metaloide germanio con un número atómico de 32.
El germanio es más abundante que otros metaloides, como el arsénico y el antimonio. Sin embargo, su alta reactividad con otros elementos significa que no se encuentra en su forma elemental en la naturaleza. A temperatura ambiente, el germanio tiene una estructura dura y quebradiza y no reacciona con el aire. Sin embargo, a medida que aumenta la temperatura, también aumenta su reactividad, lo que conduce a la formación de óxidos a aproximadamente 600-700 grados Celsius (1000-1100 grados Fahrenheit).
El germanio también se utiliza en aplicaciones de semiconductores, aunque en menor medida que el silicio. Además, tiene aplicaciones en medicina y en la fabricación de monedas.
Arsénico (As)
El elemento químico arsénico, que pertenece al grupo 15 y tiene un número atómico de 33, es un metaloide conocido por su naturaleza tóxica. A temperatura ambiente, el arsénico es estable y no reacciona con el aire. Sin embargo, en presencia de humedad, se oxida formando un deslustre dorado-bronce que acaba volviéndose negro.
La exposición prolongada al arsénico a través de los alimentos y el agua puede provocar enfermedades graves, incluido el cáncer. Sin embargo, cabe señalar que el arsénico es un oligoelemento esencial para algunos organismos. Desempeña un papel directo e indirecto en la producción de agentes biológicos tanto beneficiosos como perjudiciales.
El arsénico también se utiliza en otros sectores como la fabricación de vidrio, la producción de semiconductores, los productos químicos agrícolas y la minería.
Antimonio (Sb)
El antimonio, con el número atómico 51, se encuentra en el grupo 15 de la tabla periódica, justo debajo del arsénico. Posee un estructura dura y quebradiza, caracterizada por un aspecto plateado.
La mayor parte del antimonio se extrae de su mineral sulfurado, la estibina. China, Rusia, Bolivia y Kirguistán poseen la mayoría de las reservas de antimonio. Además, China es el mayor productor de antimonio del mundo.
El antimonio se ha utilizado tradicionalmente en aplicaciones medicinales y cosméticas. Con el tiempo, también se ha vuelto valioso en la producción de materiales ignífugos, pinturas, baterías, vidrio, cerámica, medios de almacenamiento óptico y dispositivos semiconductores como diodos y detectores de infrarrojos.
Para Europa y Estados Unidos, el antimonio es un elemento crítico, ya que se importa en un 100%. Una interrupción del suministro podría afectar gravemente a industrias esenciales como la automoción, la construcción y la defensa.
Telurio (Te)
El telurio es un metaloide raro de color blanco plateado que se descubrió por primera vez en las minas de oro como telururo de oro (también conocido como calaverita). Con una abundancia de 1 parte por billón (1 microgramo por kilogramo), el telurio es tan raro como el platino.
Hasta la fecha no se han identificado aplicaciones a gran escala del telurio. En la industria, el telurio se utiliza principalmente como elemento de aleación y en la producción de paneles solares y dispositivos termoeléctricos.
Polonio (Po)
El polonio es un metal radiactivo que a veces se clasifica como metaloide. Tiene 42 isótopos, ninguno de los cuales es estable y todos son radiactivos. La vida media de los isótopos de polonio oscila entre los 115 nanosegundos (milmillonésima de segundo) del Po-205m4 y los 124 años del Po-209.
El polonio tiene varias aplicaciones, todas las cuales utilizan sus propiedades radiactivas. Algunas de ellas son:
- Como generador termoeléctrico para vuelos espaciales
- Como dispositivo antiestático para eliminar la carga estática
- Como fuente de neutrones en combinación con berilio
Astatina (At)
Sin embargo, la astatina se clasifica generalmente como un metaloide, algunas clasificaciones la categorizan como un no metal. Es el penúltimo elemento del grupo de los halógenos, precedido por el flúor, el cloro, el bromo y el yodo, y presenta varias propiedades comunes con estos elementos.
La astatina es altamente radiactiva, y sus propiedades aún no se han estudiado en detalle, ya que nunca se ha sintetizado en cantidades suficientes para un análisis exhaustivo. Además, se sublima tan rápidamente que se puede perder la mitad en una hora.
La astatina tiene aplicaciones limitadas debido a su radiactividad y a su corta vida media. No obstante, se ha utilizado en investigación, principalmente como trazador radiactivo y en el tratamiento del cáncer de tiroides.
Conclusión
Los metaloides son un importante grupo de elementos que tienden un puente entre los metales y los no metales. Su combinación de propiedades metálicas y no metálicas permite su uso en industrias muy diversas, desde la agricultura hasta el almacenamiento óptico y la optoelectrónica.
Sus propiedades semiconductoras, en particular, han hecho avanzar significativamente la tecnología y la informática moderna. Algunos metaloides, como el arsénico, son tóxicos; sin embargo, su uso controlado ofrece beneficios sin parangón en diversos sectores.
Debido a las razones anteriores, se espera que crezca la demanda de metaloides. Sin embargo, la escasez de ciertos metaloides los ha convertido en elementos críticos. Por ejemplo, la producción de antimonio está disminuyendo a medida que las fuentes existentes se agotan rápidamente, sin que se descubran nuevos sustitutos.
Esto ha hecho que cada vez sea más importante identificar fuentes sostenibles para los metaloides. Se están realizando esfuerzos para investigar, conservar y reciclar los metaloides.
Únase al foro de diseñadores!
Su experiencia es vital para la comunidad. Únase a nosotros y aporte sus conocimientos.
Únase ahora al ForoComparta, aprenda y crezca con los mejores profesionales del sector.

