Rejoignez le forum des designers !
Votre expertise est essentielle pour la communauté. Rejoignez-nous et apportez vos connaissances !
Rejoindre le forum maintenantPartagez, apprenez et évoluez avec les meilleurs professionnels du secteur.
Les métalloïdes sont des éléments naturels uniques qui possèdent des caractéristiques à la fois des métaux et des non-métaux. Leurs propriétés distinctives rendent les métalloïdes irremplaçables dans divers scénarios. Cet article explore ce groupe d’éléments, en discutant de leurs propriétés, de leurs applications et de leur position dans le tableau périodique. Nous donnerons également un bref aperçu de chaque métalloïde communément reconnu.
- Exposition sur les métalloïdes propriétés qui sont un mélange de métaux et de non-métauxce qui les rend polyvalents pour une large gamme d’applications générales et spécialisées.
- Ils occupent une ligne en zigzag dans le tableau périodique. Les métaux se trouvent d’un côté de cette diagonale et les non-métaux de l’autre. Cette disposition indique également leurs propriétés hybrides.
- Les métalloïdes détiennent d’importantes importance dans la technologie, en particulier dans le domaine de la la fabrication de semi-conducteurs. Les semi-conducteurs sont des composants essentiels des ordinateurs, de l’électronique et des panneaux solaires.
- Certains métalloïdes, tels que le tellure et l’antimoine, sont d’importantes sources d’énergie. une importance économique et stratégique significative en raison de leur raretéce qui peut avoir un impact important sur la défense, la production d’énergie et l’industrie automobile.
Que sont les métalloïdes ?
Les métalloïdes sont des éléments distinctifs qui possèdent des propriétés intermédiaires entre les métaux et les non-métaux. Ces propriétés intermédiaires comprennent l’électronégativité, la densité, l’énergie d’ionisation, la résistance, la conductivité thermique, le point de fusion et la conductivité électrique.
L’ensemble spécifique de propriétés physiques, chimiques et mécaniques des métalloïdes les rend idéaux pour des applications spécialisées, telles que les semi-conducteurs et la production d’énergie solaire. En outre, ils sont largement utilisés dans diverses applications générales, notamment les médicaments, les herbicides et les insecticides.
L’une des raisons des propriétés intermédiaires des métalloïdes est le nombre d’électrons de valence dans leur enveloppe extérieure. Les métaux possèdent généralement de un à trois électrons dans leur enveloppe externe, tandis que les non-métaux en ont de quatre à sept. Les métalloïdes contiennent de trois à six électrons dans leur enveloppe de valence, ce qui leur permet de former des composés intermétalliques avec les métaux (liaisons ioniques) et des liaisons covalentes avec les non-métaux.
Certaines sources identifient six éléments métalloïdes, tandis que d’autres en reconnaissent jusqu’à huit. Les éléments communément reconnus dans le groupe des métalloïdes sont les suivants le bore (B), l’arsenic (As), le silicium (Si), l’antimoine (Sb), le polonium (Po), le tellure (Te), le germanium (Ge) et l’astate (At)..
Les métalloïdes dans le tableau périodique
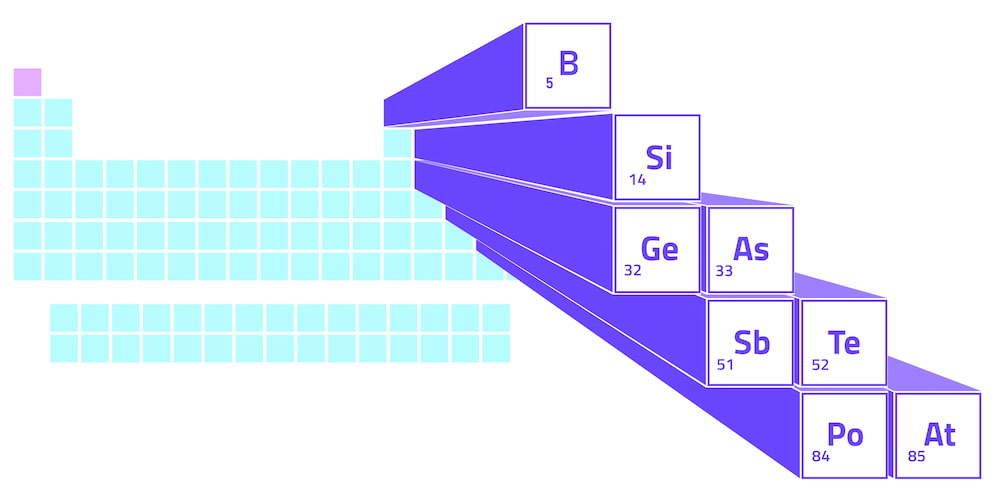
Les métalloïdes forment une ligne en zigzag dans le bloc p du tableau périodique, qui est la section surélevée du côté droit du tableau. Cette ligne en zigzag commence au niveau du bore dans le groupe 13, se déplace en diagonale jusqu’au silicium, puis continue en escalier jusqu’à l’astate dans le groupe 17. Les groupes font référence à la numérotation des colonnes du tableau périodique.
Sur le côté gauche de la ligne zigzagante des métalloïdes, on trouve les métaux (à l’exception de l’hydrogène). Du côté droit, on trouve les non-métaux. Par conséquent, la ligne métalloïdes créent une ligne de démarcation entre les métaux et les non-métaux. dans le tableau périodique.
Propriétés générales des métalloïdes
Les métalloïdes présentent une combinaison unique de propriétés qui ne sont pas présentes dans les autres éléments. Voici quelques-unes de ces propriétés :
Conductivité électrique variable
La conductivité électrique des métalloïdes est intermédiaire, se situant entre celle des métaux et celle des non-métaux. Cela est dû à leurs structures de bandes électroniques, qui ressemblent à celles des semi-métaux ou des semi-conducteurs.
Cependant, on peut améliorer leur conductivité en les dopant. Ce processus permet de créer des composants électroniques essentiels, tels que des diodes, des transistors et des circuits intégrés, qui sont fondamentaux pour l’informatique moderne.
Apparence
Les métalloïdes ont un aspect métallique et sont solides à température ambiante. Leurs surfaces brillantes et réfléchissantes conduisent souvent à les identifier à tort comme des métaux. Cet éclat métallique est également à l’origine de leur nom ; métalloïde signifie « semblable à un métal » en latin/grec.
Conductivité thermique
Les métalloïdes présentent une conductivité thermique modérée, supérieure à celle des non-métaux mais inférieure à celle des métaux. Même parmi les huit métalloïdes, la conductivité thermique varie considérablement. Certains métalloïdes sont de bons conducteurs de chaleur, tandis que d’autres sont des isolants presque parfaits. Cette propriété permet d’utiliser certains métalloïdes dans des dispositifs thermoélectriques.
Fragilité
Contrairement aux métaux, les métalloïdes n’ont pas les propriétés physiques de ductilité et de malléabilité. Ils se cassent facilement et n’ont pas la résistance requise pour les applications structurelles.
Réactivité chimique
Les métalloïdes sont assez réactifs avec les métaux et les non-métaux. Ils sont courants dans les alliages métalliques en tant qu’additifs à améliorer les propriétés des métaux de transition, ce qui leur confère des avantages tels qu’une plus grande solidité et une meilleure résistance à la corrosion.
Avec les non-métaux, les métalloïdes forment des liaisons covalentes en partageant des électrons. Leurs réactions avec les halogènes forment des composés tels que le trifluorure de bore, le trioxyde d’antimoine et le tétrahalure de silicium.
Métalloïdes courants et leurs applications
Tous les métalloïdes partagent certaines propriétés communes ; cependant, contrairement à d’autres groupes d’éléments tels que les halogènes, les métaux alcalins ou les métaux alcalino-terreux, chaque métalloïde possède également des caractéristiques uniques. Cette diversité permet d’utiliser les métalloïdes dans un large éventail d’applications.
Bore (B)
Le bore est un métalloïde noir et brillant qui constitue environ 0,001 % du poids de la croûte terrestre. Il est le le plus dur de tous les métalloïdes et présente excellente résistance à la chaleur. Sa valeur de dureté Mohs est de 9,3, contre 10 pour le diamant, qui est le matériau connu le plus dur.
Le bore est un élément polyvalent qui a de nombreuses applications. L’une d’entre elles consiste à produire du verre borosilicaté, un verre spécial très résistant à la chaleur et aux produits chimiques. Il est également utilisé pour produire des retardateurs de flamme, des cosmétiques, des insecticides et des détergents.
Les alliages nickel-bore sont utilisés comme alliages maîtres pour former des alliages tels que les superalliages à base de nickel, les aciers spéciaux et les alliages de soudure.
Le bore joue également un rôle important dans le dopage du silicium. Le dopage nous permet de produire des semi-conducteurs à base de silicium, indispensables à l’informatique moderne.
Silicium (Si)
Le silicium est le métalloïde le plus connu et l’élément le plus important de l’environnement. deuxième élément le plus abondant sur Terreaprès l’oxygène. Il constitue environ 27 % du poids de la croûte terrestre.
Il est généralement inerte à température ambiante, mais sa réactivité augmente avec la température. Il se combine à l’oxygène pour former de la silice (dioxyde de silicium), que l’on trouve dans la plupart des argiles, des roches, des sables et des sols. Il se combine avec la plupart des métaux et des alliages métalliques, leur conférant des propriétés telles que la fluidité, la résistance à la corrosion, la solidité et la résistance à la chaleur.
La silice et le silicium pur sont des matériaux essentiels à l’informatique moderne. La silice est utilisée pour produire des condensateurs qui stockent l’énergie électrique dans les circuits. Le silicium, qui est utilisé pour fabriquer des des composants électroniques essentiels des pucesLa technologie des puces électroniques nous permet de créer des appareils électroniques plus petits, plus rapides et plus puissants.
Germanium (Ge)
Directement sous le silicium dans le tableau périodique, nous avons le métalloïde germanium avec un numéro atomique de 32.
Le germanium est plus abondant que d’autres métalloïdes, tels que l’arsenic et l’antimoine. Cependant, son forte réactivité avec d’autres éléments signifie qu’on ne le trouve pas sous sa forme élémentaire dans la nature. À température ambiante, le germanium a une structure dure et fragile et ne réagit pas avec l’air. Toutefois, à mesure que la température augmente, sa réactivité augmente également, ce qui entraîne la formation d’oxydes à environ 600-700 degrés Celsius (1000-1100 degrés Fahrenheit).
Le germanium est également utilisé dans les applications de semi-conducteurs, bien que dans une moindre mesure que le silicium. Il a également des applications en médecine et dans la production de pièces de monnaie.
Arsenic (As)
L’élément chimique arsenic, qui appartient au groupe 15 et a un numéro atomique de 33, est un métalloïde connu pour ses caractéristiques suivantes nature toxique. À température ambiante, l’arsenic est stable et ne réagit pas à l’air. Toutefois, en présence d’humidité, il s’oxyde pour former une ternissure brun doré qui finit par devenir noire.
L’exposition à long terme à l’arsenic par le biais des aliments et de l’eau peut entraîner des maladies graves, y compris le cancer. Toutefois, il convient de noter que l’arsenic est un oligo-élément essentiel pour certains organismes. Il joue un rôle direct et indirect dans la production d’agents biologiques bénéfiques et nocifs.
L’arsenic est également utilisé dans d’autres secteurs tels que la fabrication du verre, la production de semi-conducteurs, les produits chimiques agricoles et l’exploitation minière.
Antimoine (Sb)
L’antimoine, dont le numéro atomique est 51, se trouve dans le groupe 15 du tableau périodique, juste en dessous de l’arsenic. Il possède une structure dure et fragilecaractérisée par un aspect argenté.
La majeure partie de l’antimoine est extraite de son minéral sulfuré, la stibnite. La Chine, la Russie, la Bolivie et le Kirghizstan détiennent la majorité des réserves d’antimoine. La Chine est d’ailleurs le plus grand producteur d’antimoine au monde.
L’antimoine est traditionnellement utilisé dans des applications médicinales et cosmétiques. Au fil du temps, il est également devenu précieux dans la production de matériaux ignifuges, de peintures, de batteries, de verre, de poterie, de supports de stockage optique et de dispositifs semi-conducteurs tels que les diodes et les détecteurs infrarouges.
Pour l’Europe et les États-Unis, l’antimoine est un élément critique, car il est importé à 100 %. Une interruption de l’approvisionnement pourrait avoir de graves répercussions sur des industries essentielles telles que l’automobile, la construction et la défense.
Tellure (Te)
Le tellure est un métalloïde rare, blanc argenté, qui a été découvert pour la première fois dans les mines d’or sous la forme de tellurure d’or (alias calaverite). Avec une abondance de 1 partie par milliard (1 microgramme par kilogramme), le tellure est un métal rare. aussi rare que le platine.
Aucune application à grande échelle du tellure n’a été identifiée à ce jour. Dans l’industrie, le tellure est principalement utilisé comme élément d’alliage et dans la production de panneaux solaires et de dispositifs thermoélectriques.
Polonium (Po)
Le polonium est un métal radioactif qui est parfois classé parmi les métalloïdes. Il possède 42 isotopes, dont aucun n’est stable et tous sont radioactifs. La demi-vie des isotopes du polonium varie de 115 nanosecondes (milliardième de seconde) pour le Po-205m4 à 124 ans pour le Po-209.
Le polonium a plusieurs applications, qui utilisent toutes ses propriétés radioactives. En voici quelques-unes :
- Générateur thermoélectrique pour les vols spatiaux
- Comme dispositif antistatique pour éliminer les charges statiques
- Comme source de neutrons en combinaison avec le béryllium
Astatine (At)
Cependant, l’astatine est généralement classée parmi les métalloïdes, certaines classifications la classent parmi les non-métaux.. Il est l’avant-dernier élément du groupe des halogènes, précédé par le fluor, le chlore, le brome et l’iode, et il présente plusieurs propriétés communes avec ces éléments.
L’astate est hautement radioactifet ses propriétés n’ont pas encore été étudiées en détail, car il n’a jamais été synthétisé en quantités suffisantes pour être analysé en profondeur. En outre, il se sublime si rapidement que vous pouvez en perdre la moitié en une heure.
L’astatine a des applications limitées en raison de sa radioactivité et de sa courte demi-vie. Néanmoins, il a été utilisé dans la recherche, principalement comme traceur radioactif et dans le traitement du cancer de la thyroïde.
Conclusion
Les métalloïdes constituent un groupe important d’éléments qui se situent entre les métaux et les non-métaux. Leur combinaison de propriétés métalliques et non métalliques leur permet d’être utilisés dans des secteurs très divers, de l’agriculture au stockage optique et à l’optoélectronique.
Leurs propriétés semi-conductrices, en particulier, ont considérablement fait progresser la technologie et l’informatique moderne. Certains métalloïdes, comme l’arsenic, sont toxiques, mais leur utilisation contrôlée offre des avantages inégalés dans divers secteurs.
Pour ces raisons, la demande de métalloïdes devrait croître. Cependant, la demande en métalloïdes devrait augmenter, la rareté de certains métalloïdes en a fait des éléments critiques. Par exemple, la production d’antimoine est en baisse car les sources existantes s’épuisent rapidement, sans qu’aucun nouveau substitut ne soit découvert.
Il est donc de plus en plus important d’identifier des sources durables pour les métalloïdes. Des efforts sont en cours pour rechercher, conserver et recycler les métalloïdes.
Rejoignez le forum des designers !
Votre expertise est essentielle pour la communauté. Rejoignez-nous et apportez vos connaissances !
Rejoindre le forum maintenantPartagez, apprenez et évoluez avec les meilleurs professionnels du secteur.

