Join the forum for Designers!
Your expertise is vital to the community. Join us and contribute your knowledge!
Join the Forum NowShare, learn and grow with the best professionals in the industry.
Metalloïden zijn unieke natuurlijke elementen die kenmerken van zowel metalen als niet-metalen bezitten. Hun bijzondere eigenschappen maken metalloïden onvervangbaar in verschillende scenario’s. Dit artikel verkent deze groep elementen en bespreekt hun eigenschappen, toepassingen en posities in het periodiek systeem. We geven ook een kort overzicht van elke algemeen erkende metalloïde.
- Metalloïden vertonen eigenschappen die een mengsel zijn van zowel metalen als niet-metalenwaardoor ze veelzijdig zijn voor een groot aantal algemene en gespecialiseerde toepassingen.
- Ze nemen een zigzaglijn in het periodiek systeem. Metalen liggen aan de ene kant van deze diagonale lijn en niet-metalen aan de andere kant. Deze indeling geeft ook hun hybride eigenschappen aan.
- Metalloïden hebben belangrijke belang in de technologie, met name in de productie van halfgeleiders. Halfgeleiders zijn essentiële onderdelen in computers, elektronica en zonnepanelen.
- Sommige metalloïden, zoals tellurium en antimoon, zijn belangrijke economisch en strategisch belang vanwege hun schaarste, wat ernstige gevolgen kan hebben voor de defensie-, energieproductie- en auto-industrie.
Wat zijn metalloïden?
Metalloïden zijn onderscheidende elementen die eigenschappen bezitten die het midden houden tussen metalen en niet-metalen. Deze intermediaire eigenschappen omvatten elektronegativiteit, dichtheid, ionisatie-energie, sterkte, thermische geleidbaarheid, smeltpunt en elektrische geleidbaarheid.
De specifieke reeks fysische, chemische en mechanische eigenschappen van metalloïden maakt ze ideaal voor gespecialiseerde toepassingen, zoals halfgeleiders en het opwekken van zonne-energie. Daarnaast worden ze op grote schaal gebruikt in verschillende algemene toepassingen, waaronder geneesmiddelen, herbiciden en insecticiden.
Een van de redenen voor de intermediaire eigenschappen van metalloïden is het aantal valentie-elektronen in hun buitenste schil. Metalen hebben meestal één tot drie elektronen in hun buitenste schil, terwijl niet-metalen er vier tot zeven hebben. Metalloïden hebben drie tot zes elektronen in hun valentieschil, waardoor ze intermetallische verbindingen kunnen vormen met metalen (ionische bindingen) en covalente bindingen met niet-metalen.
Sommige bronnen identificeren zes metalloïde elementen, terwijl anderen er wel acht erkennen. De algemeen erkende elementen in de metalloïde groep zijn onder andere boor (B), arseen (As), silicium (Si), antimoon (Sb), polonium (Po), tellurium (Te), germanium (Ge) en astatine (At).
Metalloïden in het Periodiek Systeem
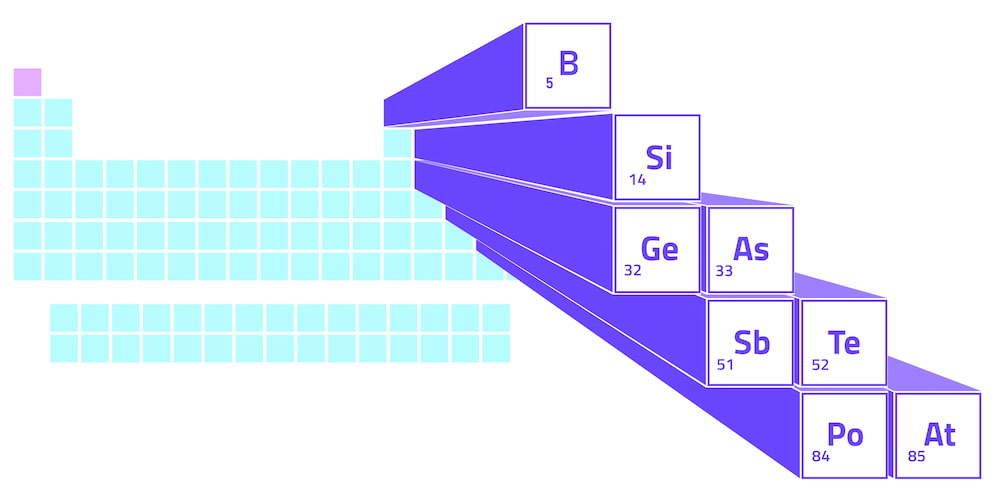
Metalloïden vormen een zigzaglijn in het p-blok van het periodiek systeem, het verhoogde gedeelte aan de rechterkant van de tabel. Deze zigzaglijn begint bij boor in groep 13, beweegt diagonaal naar silicium, en gaat dan stapsgewijs verder naar astatine in groep 17. Groepen verwijzen naar de nummering van de kolommen in het periodiek systeem.
Aan de linkerkant van de zigzag metalloïdenlijn vinden we metalen (met uitzondering van waterstof). Aan de rechterkant vinden we niet-metalen. Daarom is de metalloïden een scheidingslijn tussen metalen en niet-metalen in het periodiek systeem.
Algemene eigenschappen van metalloïden
Metalloïden vertonen een unieke combinatie van eigenschappen die niet aanwezig zijn in andere elementen. Enkele van deze eigenschappen zijn:
Variabel elektrisch geleidingsvermogen
Het elektrisch geleidingsvermogen van metalloïden ligt tussen dat van metalen en niet-metalen in. Dit wordt toegeschreven aan hun elektronische bandstructuren, die lijken op die van halfmetalen of halfgeleiders.
We kunnen echter hun geleidbaarheid verbeteren door doping. Dit proces maakt het mogelijk om essentiële elektronische componenten te maken, zoals diodes, transistors en geïntegreerde schakelingen, die fundamenteel zijn voor moderne computers.
Uiterlijk
Metalloïden zien er metaalachtig uit en zijn vast bij kamertemperatuur. Door hun glanzende, reflecterende oppervlakken worden ze vaak ten onrechte als metalen geïdentificeerd. Deze metaalglans is ook de reden achter de oorsprong van hun naam; metalloïde betekent metaalachtig in het Latijn/Grieks.
Warmtegeleidingsvermogen
Metalloïden hebben een matig warmtegeleidingsvermogen, dat hoger is dan dat van niet-metalen maar lager dan dat van metalen. Zelfs tussen de acht metalloïden varieert het warmtegeleidingsvermogen aanzienlijk. Sommige metalloïden zijn effectieve warmtegeleiders, terwijl andere bijna perfecte isolatoren zijn. Deze eigenschap maakt het gebruik van bepaalde metalloïden in thermo-elektrische apparaten mogelijk.
Broosheid
In tegenstelling tot metalen hebben metalloïden niet de fysische eigenschappen van vervormbaarheid en vervormbaarheid. Ze breken gemakkelijk en hebben niet de sterkte die nodig is voor structurele toepassingen.
Chemische reactiviteit
Metalloïden zijn redelijk reactief met metalen en niet-metalen. Ze zijn vaak in metaallegeringen als additieven naar de eigenschappen van overgangsmetalen te verbeteren, wat voordelen biedt zoals verhoogde sterkte en verbeterde corrosiebestendigheid.
Met niet-metalen vormen metalloïden covalente bindingen door elektronen te delen. Hun reacties met halogenen vormen verbindingen zoals boortrifluoride, antimoontrioxide en siliciumtetrahalide.
Veel voorkomende metalloïden en hun toepassingen
Alle metalloïden hebben bepaalde eigenschappen gemeen, maar in tegenstelling tot andere groepen elementen zoals halogenen, alkalimetalen of aardalkalimetalen, heeft elke metalloïde ook unieke kenmerken. Deze diversiteit maakt het gebruik van metalloïden in een breed scala aan toepassingen mogelijk.
Boor (B)
Boor is een zwarte, glanzende metalloïde die ongeveer 0,001% van het gewicht van de aardkorst uitmaakt. Het is de hardste van alle metalloïden en vertoont uitstekende hittebestendigheid. De hardheidswaarde van Mohs is 9,3, vergeleken met 10 voor diamant, het hardste bekende materiaal.
Borium is een veelzijdig element met een scala aan toepassingen. Een daarvan is de productie van borosilicaatglas, een speciaal glas met een hoge hittebestendigheid en chemische weerstand. Het wordt ook gebruikt voor de productie van vlamvertragers, cosmetica, insecticiden en wasmiddelen.
Nikkel-boorlegeringen worden gebruikt als basislegeringen om legeringen te vormen zoals op nikkel gebaseerde superlegeringen, speciale staalsoorten en laslegeringen.
Borium speelt ook een rol bij het doperen van silicium. Doping stelt ons in staat om op silicium gebaseerde halfgeleiders te produceren die onmisbaar zijn voor moderne computers.
Silicium (Si)
Silicium is de bekendste metalloïde en de op één na meest voorkomende element op aardena zuurstof. Het maakt ongeveer 27% van het gewicht van de aardkorst uit.
Het is over het algemeen inert bij omgevingstemperaturen, maar de reactiviteit neemt toe met de temperatuur. Het combineert met zuurstof om silica (siliciumdioxide) te vormen, dat in de meeste klei, rotsen, zand en bodems wordt gevonden. Het verbindt zich met de meeste metalen en metaallegeringen, waardoor het eigenschappen krijgt zoals vloeibaarheid, corrosiebestendigheid, sterkte en hittebestendigheid.
Silica en zuiver silicium zijn essentiële materialen in moderne computers. Silica wordt gebruikt om condensatoren die elektrische energie opslaan in schakelingen. Silicium, dat wordt gebruikt om cruciale elektronische chipcomponentenkunnen we kleinere, snellere en krachtigere elektronische apparaten maken.
Germanium (Ge)
Direct onder silicium in het periodiek systeem hebben we de metalloïde germanium met een atoomnummer van 32.
Germanium komt meer voor dan andere metalloïden, zoals arseen en antimoon. Het is echter hoge reactiviteit met andere elementen betekent dat het niet in zijn elementaire vorm in de natuur voorkomt. Bij kamertemperatuur heeft germanium een harde en brosse structuur en reageert het niet met lucht. Als de temperatuur echter toeneemt, neemt ook de reactiviteit toe, wat leidt tot de vorming van oxiden bij ongeveer 600-700 graden Celsius (1000-1100 graden Fahrenheit).
Germanium wordt ook gebruikt in halfgeleidertoepassingen, hoewel in mindere mate dan silicium. Daarnaast heeft het toepassingen in de geneeskunde en bij de productie van munten.
Arsenicum (As)
Het chemische element arseen, dat behoort tot groep 15 en een atoomnummer van 33 heeft, is een metalloïde die bekend staat om zijn giftige aard. Bij kamertemperatuur is arseen stabiel en reageert het niet met lucht. In de aanwezigheid van vocht oxideert het echter tot een goudbronzen aanslag die uiteindelijk zwart wordt.
Langdurige blootstelling aan arseen via voedsel en water kan leiden tot ernstige ziekten, waaronder kanker. Het is echter vermeldenswaard dat arseen voor sommige organismen een essentieel sporenelement is. Het speelt een directe en indirecte rol in de productie van zowel heilzame als schadelijke biologische agentia.
Arseen wordt ook gebruikt in andere sectoren, zoals glasproductie, halfgeleiderproductie, landbouwchemicaliën en mijnbouw.
Antimoon (Sb)
Antimoon, met atoomnummer 51, bevindt zich in groep 15 van het periodiek systeem, direct onder arseen. Het bezit een harde en brosse structuurgekenmerkt door een zilverachtig uiterlijk.
Het meeste antimoon wordt gewonnen uit het sulfide mineraal, stibniet, waarbij China, Rusland, Bolivia en Kirgizië de meeste antimoonreserves bezitten. Bovendien is China de grootste producent van antimoon ter wereld.
Antimoon wordt van oudsher gebruikt in medicinale en cosmetische toepassingen. In de loop der tijd is het ook waardevol geworden voor de productie van vlamvertragende materialen, verf, batterijen, glas, aardewerk, optische opslagmedia en halfgeleiders zoals diodes en infrarooddetectoren.
Voor Europa en de Verenigde Staten is antimoon een kritiek element, omdat het voor 100% geïmporteerd wordt. Een onderbreking in de aanvoer zou ernstige gevolgen kunnen hebben voor essentiële industrieën zoals de auto-industrie, de bouw en defensie.
Tellurium (Te)
Tellurium is een zeldzame, zilverwitte metalloïde die voor het eerst ontdekt werd in goudmijnen als goudtelluride (ook wel calaveriet genoemd). Met een abundantie van 1 deel per miljard (1 microgram per kilogram) is tellurium net zo zeldzaam als platina.
Tot op heden zijn er geen grootschalige toepassingen van tellurium geïdentificeerd. In de industrie wordt tellurium voornamelijk gebruikt als legeringselement en bij de productie van zonnepanelen en thermo-elektrische apparaten.
Polonium (Po)
Polonium is een radioactief metaal dat soms wordt geclassificeerd als een metalloïde. Het heeft 42 isotopen, waarvan geen enkele stabiel en allemaal radioactief is. De halfwaardetijd van poloniumisotopen varieert van 115 nanoseconden (miljardste van een seconde) voor Po-205m4 tot 124 jaar voor Po-209.
Polonium heeft verschillende toepassingen, die allemaal gebruik maken van zijn radioactieve eigenschappen. Enkele hiervan zijn:
- Als thermo-elektrische generator voor ruimtevluchten
- Als antistatisch apparaat om statische lading te elimineren
- Als neutronenbron in combinatie met beryllium
Astatine (At)
Astatine wordt echter over het algemeen geclassificeerd als een metalloïde, sommige classificaties categoriseren het als een niet-metaal. Het is het een-na-laatste element in de halogeengroep, voorafgegaan door fluor, chloor, broom en jodium, en het vertoont verschillende gemeenschappelijke eigenschappen met deze elementen.
Astatine is zeer radioactiefen de eigenschappen ervan moeten nog in detail worden bestudeerd, omdat het nooit in voldoende hoeveelheden is gesynthetiseerd voor een grondige analyse. Bovendien sublimeert het zo snel dat u de helft binnen een uur kunt verliezen.
Astatine heeft beperkte toepassingen vanwege de radioactiviteit en korte halfwaardetijd. Toch is het in onderzoek gebruikt, voornamelijk als radioactieve tracer en bij de behandeling van schildklierkanker.
Conclusie
Metalloïden zijn een belangrijke groep elementen die de kloof tussen metalen en niet-metalen overbruggen. Hun combinatie van metaal- en niet-metaaleigenschappen maakt hun gebruik in zeer uiteenlopende industrieën mogelijk, van landbouw tot optische opslag en opto-elektronica.
Vooral hun halfgeleidende eigenschappen hebben de technologie en moderne computers aanzienlijk vooruitgeholpen. Sommige metalloïden, zoals arseen, zijn giftig, maar het gecontroleerde gebruik ervan biedt ongekende voordelen in verschillende sectoren.
Vanwege bovenstaande redenen zal de vraag naar metalloïden naar verwachting groeien. Echter, heeft de schaarste van bepaalde metalloïden ervoor gezorgd dat ze kritieke elementen zijn geworden.. De productie van antimoon neemt bijvoorbeeld af omdat de bestaande bronnen snel uitgeput raken en er geen nieuwe vervangers worden ontdekt.
Hierdoor wordt het steeds belangrijker om duurzame bronnen voor metalloïden te vinden. Er worden inspanningen geleverd om metalloïden te onderzoeken, te conserveren en te recyclen.
Join the forum for Designers!
Your expertise is vital to the community. Join us and contribute your knowledge!
Join the Forum NowShare, learn and grow with the best professionals in the industry.

