Participe do fórum para Designers!
Sua experiência é vital para a comunidade. Junte-se a nós e contribua com seu conhecimento!
Participe do fórum agoraCompartilhe, aprenda e cresça com os melhores profissionais do setor.
Os metaloides são elementos naturais exclusivos que possuem características de metais e não metais. Suas propriedades distintas tornam os metaloides insubstituíveis em vários cenários. Este artigo explora esse grupo de elementos, discutindo suas propriedades, aplicações e posições na tabela periódica. Também apresentaremos uma breve visão geral de cada metaloide comumente reconhecido.
- Exposição de metaloides propriedades que são uma mistura de metais e não metaiso que os torna versáteis para uma ampla gama de aplicações gerais e especializadas.
- Eles ocupam um linha em ziguezague na tabela periódica. Os metais estão em um lado dessa região diagonal e os não-metais estão no outro. Essa disposição também indica suas propriedades híbridas.
- Os metaloides possuem importância na tecnologiaparticularmente na fabricação de semicondutores. Os semicondutores são componentes essenciais em computadores, eletrônicos e painéis solares.
- Alguns metaloides, como o telúrio e o antimônio, têm uma importância econômica e estratégica devido à sua escassez, o que pode afetar gravemente os setores de defesa, produção de energia e automotivo.
O que são metaloides?
Os metaloides são elementos distintos que possuem propriedades intermediárias entre metais e não-metais. Essas propriedades intermediárias incluem eletronegatividade, densidade, energia de ionização, resistência, condutividade térmica, ponto de fusão e condutividade elétrica.
O conjunto específico de propriedades físicas, químicas e mecânicas encontrado nos metaloides os torna ideais para aplicações especializadas, como semicondutores e geração de energia solar. Além disso, eles são amplamente utilizados em várias aplicações gerais, incluindo medicamentos, herbicidas e inseticidas.
Um dos motivos para as propriedades intermediárias dos metaloides é o número de elétrons de valência em sua camada externa. Os metais normalmente possuem de um a três elétrons em sua camada externa, enquanto os não-metais têm de quatro a sete. Os metaloides contêm de três a seis elétrons em sua camada de valência, o que lhes permite formar compostos intermetálicos com metais (ligações iônicas) e ligações covalentes com não-metais.
Algumas fontes identificam seis elementos metaloides, enquanto outras reconhecem até oito. Os elementos comumente reconhecidos no grupo dos metaloides incluem boro (B), arsênio (As), silício (Si), antimônio (Sb), polônio (Po), telúrio (Te), germânio (Ge) e astato (At).
Metalóides na Tabela Periódica
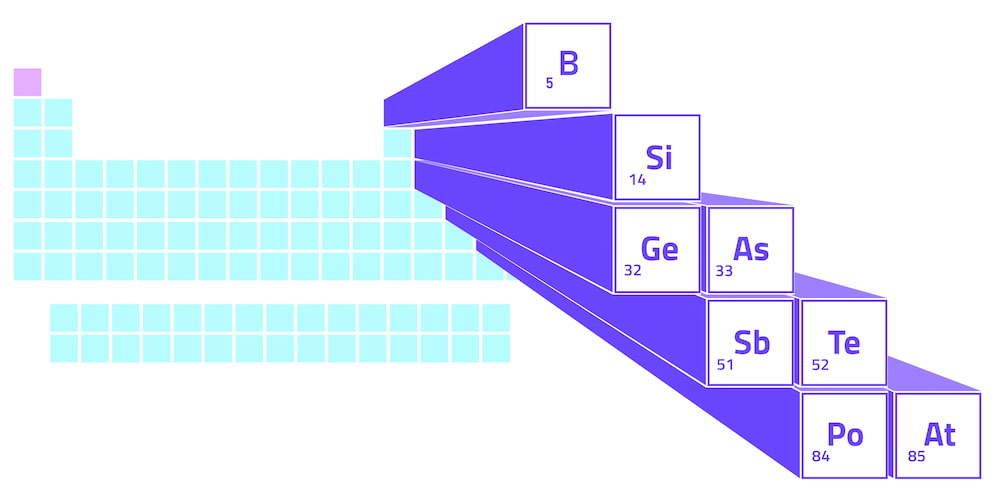
Os metaloides formam uma linha em ziguezague no bloco p da tabela periódica, que é a seção em relevo no lado direito da tabela. Essa linha em ziguezague começa com o boro no grupo 13, move-se diagonalmente até o silício e continua em forma de degrau até a astatina no grupo 17. Os grupos referem-se à numeração das colunas na tabela periódica.
No lado esquerdo da linha de metaloides em ziguezague, encontramos os metais (com exceção do hidrogênio). No lado direito, temos os não-metais. Portanto, o metaloides criam uma linha divisória entre metais e não metais na tabela periódica.
Propriedades gerais dos metaloides
Os metaloides exibem uma combinação exclusiva de propriedades que não estão presentes em outros elementos. Algumas dessas propriedades incluem:
Condutividade elétrica variável
A condutividade elétrica dos metaloides é intermediária, ficando entre a dos metais e a dos não-metais. Isso é atribuído às suas estruturas de banda eletrônica, que se assemelham às dos semimetais ou semicondutores.
No entanto, podemos aumentar sua condutividade por meio da dopagem. Esse processo permite a criação de componentes eletrônicos essenciais, como diodos, transistores e circuitos integrados, que são fundamentais para a computação moderna.
Aparência
Os metaloides têm aparência metálica e são sólidos em temperatura ambiente. Suas superfícies brilhantes e reflexivas muitas vezes fazem com que sejam erroneamente identificados como metais. Esse brilho metálico também é a razão por trás da origem de seu nome; metaloide significa semelhante a metal em latim/grego.
Condutividade térmica
Os metaloides exibem condutividade térmica moderada, que é maior do que a dos não-metais, mas menor do que a dos metais. Mesmo entre os oito metaloides, a condutividade térmica varia significativamente. Alguns metaloides são condutores de calor eficazes, enquanto outros funcionam como isolantes quase perfeitos. Essa propriedade permite o uso de certos metaloides em dispositivos termoelétricos.
Fragilidade
Ao contrário dos metais, os metaloides não têm as propriedades físicas de ductilidade e maleabilidade. Eles se quebram facilmente e não têm a resistência necessária para aplicações estruturais.
Reatividade química
Os metaloides são bastante reativos com metais e não metais. Eles são comuns em ligas metálicas como aditivos para aprimorar as propriedades dos metais de transição, proporcionando benefícios como maior força e melhor resistência à corrosão.
Com os não metais, os metaloides formam ligações covalentes compartilhando elétrons. Suas reações com halogênios formam compostos como o trifluoreto de boro, o trióxido de antimônio e o tetrahaleto de silício.
Metaloides comuns e suas aplicações
Todos os metaloides compartilham certas propriedades comuns; no entanto, diferentemente de outros grupos de elementos, como halogênios, metais alcalinos ou metais alcalino-terrosos, cada metaloide também possui características exclusivas. Essa diversidade permite a utilização de metaloides em uma ampla gama de aplicações.
Boro (B)
O boro é um metaloide preto e lustroso que constitui aproximadamente 0,001% da crosta terrestre em peso. Ele é o mais duro de todos os metaloides e apresenta excelente resistência ao calor. Seu valor de dureza Mohs é 9,3, comparado ao 10 do diamante, que é o material mais duro conhecido.
O boro é um elemento versátil com uma série de aplicações. Uma delas é a produção de vidro borossilicato, um vidro especial com alta resistência química e ao calor. Ele também é usado para produzir retardadores de chama, cosméticos, inseticidas e detergentes.
As ligas de níquel-boro são usadas como ligas principais para formar ligas como superligas à base de níquel, aços especiais e ligas de soldagem.
O boro também é fundamental na dopagem de silício. A dopagem nos permite produzir semicondutores à base de silício que são indispensáveis para a computação moderna.
Silício (Si)
O silício é o metaloide mais conhecido e o segundo elemento mais abundante na Terra, depois do oxigênio. Ele constitui aproximadamente 27% do peso da crosta terrestre.
Em geral, é inerte em temperaturas ambientes; no entanto, sua reatividade aumenta com a temperatura. Combina-se com o oxigênio para formar a sílica (dióxido de silício), que é encontrada na maioria das argilas, rochas, areias e solos. Combina-se com a maioria dos metais e ligas metálicas, conferindo propriedades como fluidez, resistência à corrosão, força e resistência ao calor.
A sílica e o silício puro são materiais essenciais na computação moderna. A sílica é usada para produzir capacitores que armazenam energia elétrica em circuitos. O silício, que é usado para fabricar componentes críticos de chips eletrônicospermite a criação de dispositivos eletrônicos menores, mais rápidos e mais potentes.
Germânio (Ge)
Logo abaixo do silício na tabela periódica, temos o germânio metaloide com número atômico 32.
O germânio é mais abundante do que outros metaloides, como o arsênio e o antimônio. Entretanto, seu alta reatividade com outros elementos significa que ele não é encontrado em sua forma elementar na natureza. À temperatura ambiente, o germânio tem uma estrutura dura e quebradiça e não reage com o ar. Entretanto, à medida que a temperatura aumenta, sua reatividade também aumenta, levando à formação de óxidos a aproximadamente 600-700 graus Celsius (1000-1100 graus Fahrenheit).
O germânio também é usado em aplicações de semicondutores, embora em menor grau do que o silício. Além disso, ele tem aplicações na medicina e na produção de moedas.
Arsênico (As)
O elemento químico arsênio, que pertence ao grupo 15 e tem um número atômico de 33, é um metaloide conhecido por sua natureza tóxica. Em temperatura ambiente, o arsênico é estável e não reage com o ar. Entretanto, na presença de umidade, ele se oxida, formando uma mancha bronze-dourada que acaba ficando preta.
A exposição prolongada ao arsênico por meio de alimentos e água pode levar a doenças graves, inclusive câncer. Entretanto, vale a pena observar que o arsênio é um oligoelemento essencial para alguns organismos. Ele desempenha um papel direto e indireto na produção de agentes biológicos benéficos e prejudiciais.
O arsênio também é usado em outros setores, como fabricação de vidro, produção de semicondutores, produtos químicos agrícolas e mineração.
Antimônio (Sb)
O antimônio, com número atômico 51, é encontrado no grupo 15 da tabela periódica, logo abaixo do arsênico. Ele possui um estrutura dura e quebradiça, caracterizada por uma aparência prateada.
A maior parte do antimônio é extraída de seu mineral de sulfeto, a estibnita, sendo que a China, a Rússia, a Bolívia e o Quirguistão detêm a maioria das reservas de antimônio. Além disso, a China é o maior produtor de antimônio do mundo.
Tradicionalmente, o antimônio tem sido usado em aplicações medicinais e cosméticas. Com o tempo, ele também se tornou valioso na produção de materiais retardadores de chamas, tintas, baterias, vidro, cerâmica, mídia de armazenamento óptico e dispositivos semicondutores, como diodos e detectores de infravermelho.
Para a Europa e os Estados Unidos, o antimônio é um elemento essencial, pois 100% dele é importado. Uma interrupção no fornecimento poderia afetar gravemente setores essenciais como o automotivo, o de construção e o de defesa.
Telúrio (Te)
O telúrio é um metaloide raro, branco-prateado, que foi descoberto pela primeira vez em minas de ouro como telureto de ouro (também conhecido como calaverita). Com uma abundância de 1 parte por bilhão (1 micrograma por quilograma), o telúrio é tão raro quanto a platina.
Até o momento, não foram identificadas aplicações em larga escala do telúrio. Na indústria, o telúrio é usado principalmente como elemento de liga e na produção de painéis solares e dispositivos termoelétricos.
Polônio (Po)
O polônio é um metal radioativo que às vezes é classificado como metaloide. Ele tem 42 isótopos, nenhum dos quais é estável e todos são radioativos. A meia-vida dos isótopos de polônio varia de 115 nanossegundos (bilionésimo de segundo) para o Po-205m4 a 124 anos para o Po-209.
O polônio tem várias aplicações, todas elas usando suas propriedades radioativas. Algumas delas são:
- Como um gerador termoelétrico para voos espaciais
- Como um dispositivo antiestático para eliminar a carga estática
- Como fonte de nêutrons em combinação com berílio
Astatina (At)
No entanto, a astrabina é geralmente classificada como um metaloide, algumas classificações a classificam como um não metal. É o penúltimo elemento do grupo dos halogênios, precedido pelo flúor, cloro, bromo e iodo, e apresenta várias propriedades comuns a esses elementos.
A astrabina é altamente radioativoe suas propriedades ainda não foram estudadas em detalhes, pois nunca foi sintetizado em quantidades suficientes para uma análise completa. Além disso, ele sublima tão rapidamente que o senhor pode perder metade dele em uma hora.
A astrabina tem aplicações limitadas devido à sua radioatividade e meia-vida curta. No entanto, ele tem sido utilizado em pesquisas, principalmente como rastreador radioativo e no tratamento do câncer de tireoide.
Conclusão
Os metaloides são um importante grupo de elementos que preenchem a lacuna entre metais e não metais. Sua combinação de propriedades metálicas e não metálicas permite seu uso em diversos setores, desde a agricultura até o armazenamento óptico e a optoeletrônica.
Suas propriedades semicondutoras, em particular, têm avançado significativamente a tecnologia e a computação moderna. Alguns metaloides, como o arsênico, são tóxicos, mas seu uso controlado oferece benefícios inigualáveis em vários setores.
Devido aos motivos acima, espera-se que a demanda por metaloides cresça. No entanto, a escassez de certos metaloides os tornou elementos críticos. Por exemplo, a produção de antimônio está em declínio, pois as fontes existentes estão se esgotando rapidamente, sem que novos substitutos sejam descobertos.
Isso tornou cada vez mais importante a identificação de fontes sustentáveis de metaloides. Há esforços em andamento para pesquisar, conservar e reciclar metaloides.
Participe do fórum para Designers!
Sua experiência é vital para a comunidade. Junte-se a nós e contribua com seu conhecimento!
Participe do fórum agoraCompartilhe, aprenda e cresça com os melhores profissionais do setor.

